卢国栋教授通过多学科团队合作揭示ACSL4在肝癌靶向治疗中的新角色
肝细胞癌(HCC)是全球范围内的重大健康挑战,而脂质代谢异常是肝细胞癌发生和发展的重要推动力。然而,脂质代谢在HCC发展的具体作用和预后意义仍未完全明确。
2024年11月,复旦大学公共卫生学院的卢国栋教授作为最后通讯作者,携手广西医科大学的周静教授、第一附属医院肝胆外科的彭涛主任医师以及新加坡国立大学的Hooi SC教授,组成多学科团队,在《Journal of Experimental and Clinical Cancer Research》上发表了题为《The prognostic role of ACSL4 in postoperative adjuvant TACE-treated HCC: implications for therapeutic response and mechanistic insights》的研究论文。该研究首次系统揭示了ACSL4在肝癌TACE治疗中的预后意义及其分子机制。
研究背景与发现
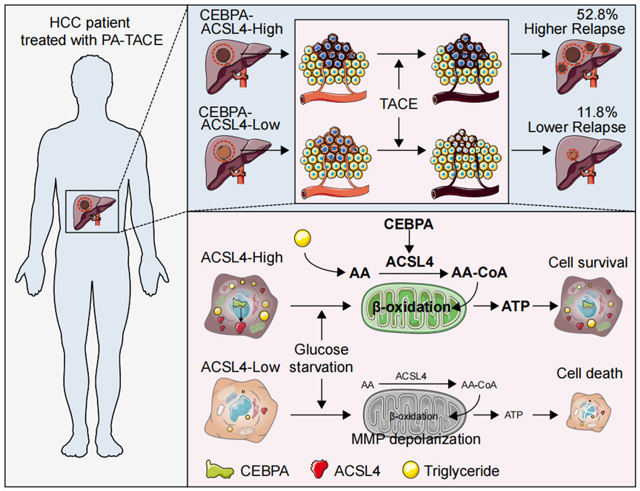
研究采用“临床-实验室-临床(bedside-bench-bedside)”模式,首先通过新加坡的HCC临床队列进行流行病学研究,发现长链脂肪酸辅酶A合成酶4(ACSL4)在HCC组织中表达显著上调,并与肝动脉化学栓塞治疗(TACE)后患者的不良预后密切相关。随后,研究团队通过体外细胞实验和临床前动物模型深入探讨了ACSL4的关键分子机制。最后,研究回到临床,利用广西的HCC队列验证了ACSL4在术后进行肝动脉化疗栓塞(PA-TACE)辅助治疗中的预后预测作用。
ACSL4及其家族成员是脂质代谢中的关键酶,负责将长链多不饱和脂肪酸(如花生四烯酸)活化为脂酰辅酶A(Acyl-CoA)。这一过程是脂肪酸代谢的起点,支持两大核心功能:(1)脂质合成:提供活化脂肪酸作为膜磷脂和储存脂肪合成的原料,维持细胞膜的动态平衡;(2)脂质分解:在能量需求增加或营养缺乏(如缺糖)时,ACSL4促进脂肪酸β-氧化,通过生成ATP为细胞提供能量。此外,ACSL4还通过调控脂质过氧化在铁死亡中发挥重要作用,因此成为癌症治疗中的一个备受关注的代谢调控靶点。
研究亮点
1. ACSL4可作为预后标志物,指导肝癌患者精准治疗方案的选择
本研究发现,ACSL4高表达的HCC患者在肝动脉栓塞治疗后的复发率高达52.8%,总体生存时间较短;而低表达ACSL4的患者则显示出更好的治疗效果(仅有11.8%的复发率),提示ACSL4可以作为肝动脉栓塞治疗的预后标志物。此外,研究团队在2020年的另一项研究中发现,在接受肝癌一线药物索拉非尼治疗的患者中,ACSL4的表达与较好的治疗预后相关,其作用机制在于ACSL4能够促进索拉非尼诱导的铁死亡(Acta Pharmacol Sin. 2021 Jan;42(1):160-170)。
结合这两项研究,ACSL4有望作为预测标志物,指导不同的肝癌治疗方案,从而实现个性化精准治疗。
2. ACSL4在肿瘤细胞存活中的分子机制
ACSL4通过促进脂肪酸β-氧化生成ATP并维持线粒体膜电位,在肿瘤细胞适应缺糖环境中发挥了关键作用。这一功能不仅帮助肿瘤细胞在低营养状态下存活,同时研究表明,抑制ACSL4活性或基因敲除会显著增强缺糖诱导的细胞死亡。此外,动物实验显示,ACSL4低表达的肿瘤对模拟缺糖环境的药物(如SGLT2抑制剂卡格列净)表现出更高的敏感性。
进一步研究发现,转录因子CEBPA是ACSL4的上游调控因子,其高表达与HCC患者在TACE治疗后的较差疗效密切相关。这一发现揭示了CEBPA与ACSL4之间的调控关系,为理解HCC的代谢机制提供了更全面的视角,同时为个性化治疗策略的优化奠定了基础。
探索基于CEBPA/ACSL4通路的个性化肝细胞癌治疗策略,将有助于改善患者的治疗效果和生存率。继续关注这一领域的进展,将为我们提供更多关于肝细胞癌代谢机制的洞见,并可能推动新型治疗方案的开发。
复旦大学公共卫生学院冯吉博士后、广西医科大学宾金莲硕士、吴勇博士、唐玥硕士以及广西医科大学第一附属医院廖锡文博士为本文第一作者。复旦大学公共卫生学院卢国栋教授、广西医科大学周静教授、广西医科大学第一附属医院彭涛教授以及新加坡国立大学Shing Chuan Hooi教授为本文共同通讯作者。
(J Exp Clin Cancer Res. 2024 Nov 19;43(1):306)
本文链接:https://pubmed.ncbi.nlm.nih.gov/39563427/








