复旦大学余宏杰课题组在人感染禽流感H5病毒的传播与进化领域取得重要进展
近期,复旦大学余宏杰课题组在人感染禽流感H5病毒的全球传播与进化领域取得重要进展。相关研究以“Human infections with avian influenza a(H5) viruses with potential pandemic risk: 1997-2025”为题,于11月10日以Research Article的形式发表在National Science Review(论文链接:https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwaf471/8317928)。
余宏杰课题组前期围绕人感染季节性流感和动物源性流感病毒[包括禽流感病毒(avian influenza virus, AIV)和猪流感病毒(swine influenza virus, SIV)],开展了基于流行病学、传染病学、病原微生物学、系统免疫学、数学建模、进化动力学等多学科交叉研究。针对季节性流感,解析了其在全球范围内的传播和进化模式(Science 2024);定量刻画了甲型H1N1流感病毒感染后的疾病自然进程和病毒排出动力学特征(BMJ 2010),以及我国季节性流感病毒分型别和毒株区域流行的季节性和疾病负担(PLoS Medicine 2013; Lancet Public Health 2019; Lancet Microbe 2023)。针对人感染禽流感病毒,还原了A(H5N1)和A(H7N9)疫情的自然演进历程(Lancet 2013a; Lancet Infectious Disease 2016, 2017);阐明了A(H7N9)高精度感染疾病谱(Lancet 2013b),以及病毒自然循环、高风险人群和人为干预措施间的多维交互博弈机制(Lancet 2014; Nature Communications 2014)。基于上述研究,余宏杰课题组又针对近年来地理分布范围不断扩大、跨种传播事件更为频繁的高致病性禽流感A(H5)病毒,系统阐明了其在全球范围内的演化、变异轨迹,以及人群疾病负担和关键传播动力学参数。
2021年以来,禽流感A(H5)病毒2.3.4.4b分支已成为引发全球禽间疫情暴发的主导谱系之一。尤其2024年美国首例疑似A(H5N1)牛-人传播事件发生以来,人类病例数激增,其感染来源(禽类 vs 禽类+奶牛)和临床严重性(1997-2015年 vs 2024-2025年住院率:90.3%,819/907 vs 6.7%,4/70)较以往也发生了明显变化。然而,受限于缺少全球标准化的流行病学与病毒基因组学数据库,且不同WHO区域、国家间病例报告质量存在异质性,下列科学问题仍未解答:自1997年首例人感染禽流感A(H5)病例报告以来,病毒如何在全球范围内演化、变异?其在动物-人层面的传播轨迹如何?人群流行特征、疾病负担与禽-人和人-人传播动力学参数因病毒变异而呈现何种变化?
为此,余宏杰课题组系统收集了1997-2025年全球报告的人感染禽流感A(H5)病例个案和病毒基因组学数据。通过系统进化动力学研究,发现禽流感A(H5)病毒分支频繁更替,在特定区域呈现区域性优势流行(图1)。例如,2.3.4x分支在2005-2013年间主导了中国和越南的疫情;相较之下,2.3.2.1x分支自2008起持续成为WHO西太平洋区、东南亚区和美洲区的主要流行谱系,并一直保持流行优势至今。此外,研究还证实了动物-人间疫情的时间关联性(rs = 0.26,p = 0.024),而禽流感A(H5)病毒跨宿主传播到人的发生时间远远滞后于其在动物宿主间的传播,两者平均时间间隔为66个月(四分位距,IQR:24–88个月)。
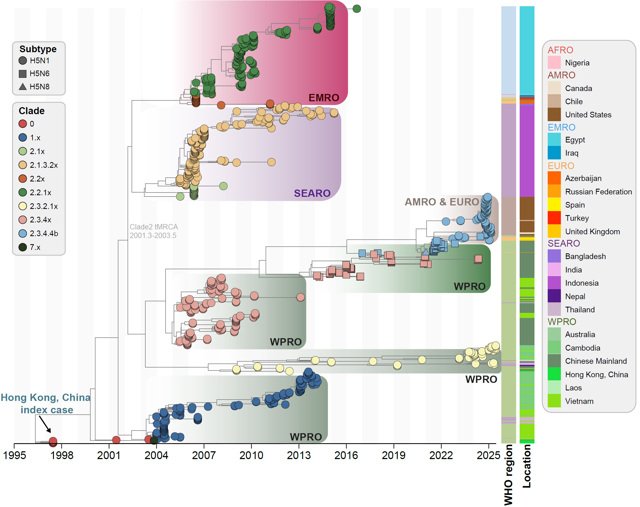
图1. 全球人感染禽流感A(H5)病毒的系统进化分析
研究还发现,在1104例人感染禽流感A(H5)病例中[包括1009名A(H5N1)病例、88名A(H5N6)病例和7名A(H5N8)病例],87.8%的病例(N=969)发生在北半球国家,流行高峰集中在每年冬春季。相比A(H5N1)病例的全球广泛分布,A(H5N6)病例(中国:N=87,98.9%)和A(H5N8)病例(俄罗斯:N=7,100%)呈现高度区域性聚集。禽流感A(H5N1)病例的年龄(中位年龄:18岁,IQR:5-32岁)普遍低于A(H5N6)病例(中位年龄:50岁,IQR:35-57岁)和A(H5N8)病例(范围:29-60岁)。此外,自2.3.4.4b分支出现以来,病例主要感染来源由此前的后院家禽、活禽市场及其被污染的环境暴露(95.6-100%)转变为规模化养殖的禽类、奶牛暴露(92.8%,65/70)(p<0.001)。
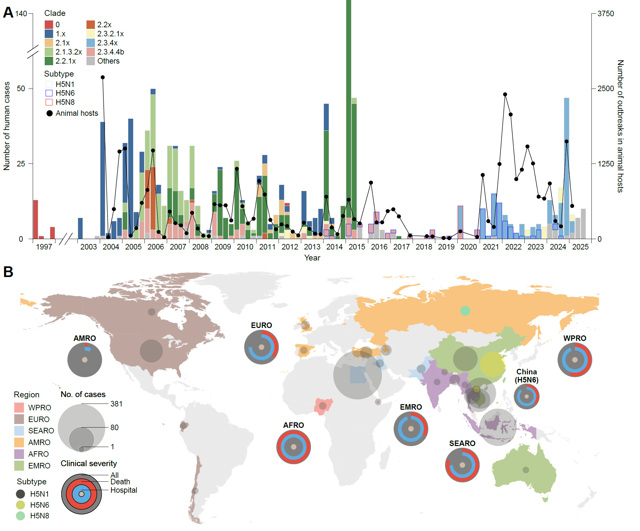
图2. 全球人感染禽流感A(H5)病例的时空分布
研究进一步构建广义线性混合效应模型,识别了禽流感A(H5)病死风险的影响因素,包括个体所感染的神经氨酸酶亚型(Neuraminidase, NA)、病毒宿主类型和病例报告时间。其中,与N1亚型的感染者相比,人感染N6亚型的死亡风险高6.30倍(95%CI 2.36-16.84倍,p<0.001);与牛源2.3.4.4b相比,禽源2.3.4.4b感染后的病死风险无显著变化(OR=0.37,95%CI 0.12-1.15,p=0.087),但显著低于禽源其他分支(OR:4.06-104.9)。研究还发现,新冠大流行前的病死风险是大流行后的1.83-9.39倍(p<0.05),强调了病例报告质量对疾病严重性估计的影响。
随后,通过构建贝叶斯泊松模型,校正了病例报告质量的时空异质性(报告率均值:73.9%,范围:57.3-98.1%),估算了不同禽流感A(H5)病例的住院与死亡风险(图3)。结果发现,牛源A(H5N1) 2.3.4.4b的每日感染数(0.595,95%CI:0.588-0.601)高于禽源A(H5N1)和A(H5N6)其他分支(0.587,95%CI:0.512-0.661,p=0.019)。此外,无论何种NA亚型,2.3.4.4b分支(范围:0.7-1.6%)和A(H5N6) 2.3.4x分支(0%,95%CI 0-1.1%)的病例死亡风险均低于其他A(H5)分支(范围:4.7-15.0%)。
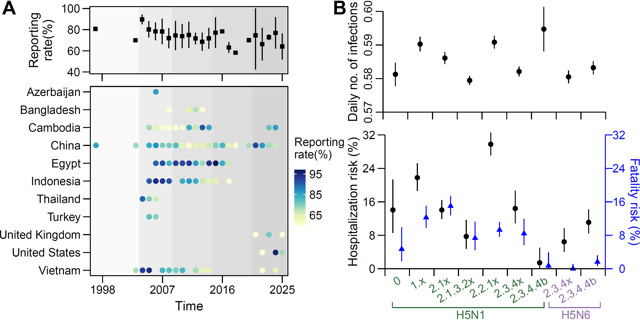
图3. 禽流感A(H5)病例报告率及疾病严重性估计
(A:分年份、国家的病例报告率;B:每日感染人数、住院与病死风险估计)
最后,构建了禽流感A(H5)病毒的传播动力学模型,以此确定了各主要流行分支的动物-人和人-人传播风险。结果发现,该模型可以较好还原2004年越南(病例报告数 vs 模型估计值:21 vs 20,95% CI:16-32)、2006年印度尼西亚(20 vs 19,95% CI:16-32)、2014-2015年埃及(160 vs 161,95% CI:102-235)和2024年美国A(H5N1)疫情(31 vs 32,95% CI:16-32),以及2022年我国A(H5N6)(23 vs 18,95%CI:10-20)的疫情发生、发展趋势。基于验证后的模型,进一步确定了各病毒所致动物-人的年度发病率以及人际间传播的有效再生数。其中,牛源A(H5N1) 2.3.4.4b分支跨宿主传播到人的年度发病率最高(7.85,95%CI 7.48-8.21/100万人),随后依次为禽源A(H5N6) 2.3.4.4b(5.04,95%CI 5.00-5.07/100万人)及A(H5N1) 1.x(3.98,95%CI 3.69-4.27/100万人)、2.2.1x(1.93,95%CI 1.88-1.97/100万人)和2.1x(1.54,95%CI 1.45-1.64/100万人)。研究还发现,牛源A(H5N1) 2.3.4.4b分支出现前、后,各禽流感A(H5)分支在人际间传播的有效再生数未发生显著变化(均值:0.19,范围:0.10-0.23),提示其人际间持续传播风险仍较低。
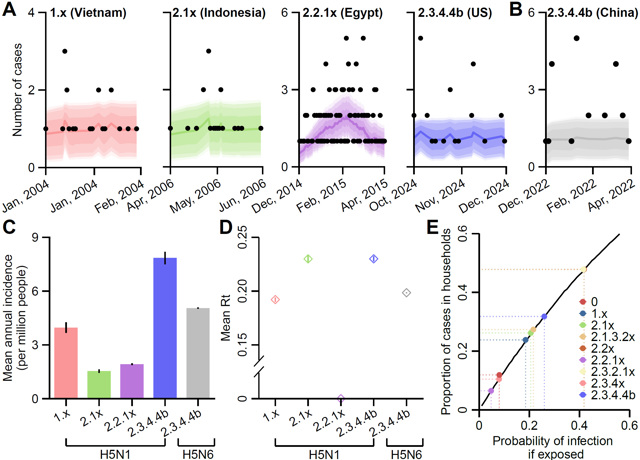
图4. 人感染禽流感A(H5)病毒的动物-人和人-人传播能力估计
(A–B:模型拟合效果评估;C:动物传人的年发病率;D:有效再生数;E:家庭情境下的人-人传播概率)
研究结果定量刻画了1997年人感染禽流感A(H5)病毒以来,病毒变异如何影响人群时空流行特征、临床严重程度和关键传播动力学参数的变化,强调了病例报告质量对理解人群真实的病毒感染发生风险和临床严重性的重要性。尽管目前禽流感A(H5)病毒的人际持续传播能力较低,但自2.3.4.4b分支在全球广泛流行以来,其跨宿主传播到人的风险显著提升,提示全球公共卫生领域应给予高度关注。相关结果也直接支撑禽流感A(H5)病毒引发大流行风险的评估和应急响应策略的制定。
复旦大学公共卫生学院青年研究员王微和2024级博士生邢家宝为共同第一作者,复旦大学公共卫生学院教授余宏杰为通讯作者。本研究得到国家自然科学基金委项目的资助(82130093、82304205、824B2101)。








